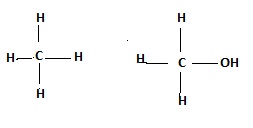
ALCOHOLES
Los alcoholes se forman cuando se sustituye en los
hidrocarburos uno a mas átomos de hidrógeno por uno a mas grupos oxhidrilo (-OH) . De formula R-OH
PROPIEDADES FÍSICAS Y QUÍMICAS DE LOS ALCOHOLES MÁS COMUNES
Metanol
Se obtiene al hacer reaccionar monóxido de carbono (CO) con
hidrogeno (H2)
CO + 2H2 → CH3 – OH
PROPIEDADES:
1-
Es un
líquido incoloro
2-
Tiene olor agradable
3-
Es menos denso que el agua y muy soluble en ella
4-
Es muy toxico
Etanol
El etanol (CH3—CH2—OH) también recibe el nombre de alcohol etílico:
gran parte del alcohol se produce a partir del
eteno.
PROPIEDADES:
1-
Es un líquido
incoloro
2-
Su olor es característico
3-
Tiene sabor caustico y ardiente
4-
Arde con llama luminosa
5-
Soluble en agua en todas proporciones
Propanotriol
El Propanotriol resive el nombre común de glicerina es un alcohol polivalente
PROPIEDADES:
1-
Liquido espeso
2-
Incoloro
3-
No tiene olor
4-
Sabor dulce
5-
Untuoso al tacto
6-
Soluble en agua en todas proporciones
FORMULA DEL PROPANOTRIOL:
(Constantes Físicas de algunos alcoholes)
Nombre Punto de fusión ºC Punto de ebullición ºC Densidad
Metanol -97,5
64,5 0,793
1-propanol -126 97,8
0,804
2-propanol -86 82,3
0,789
1-butanol -90 117
0,810
2-butanol -114
99,5 0,806
2-metil-1-propanol
-108 107,3 0,802
2-metil-2-propanol
25,5 82,8 0,789
1-pentanol -78,5 1380,817
Ciclohexanol 24 161,50,962
FUNCIONES EN EL
ORGANISMO
El proceso de la descomposición del alcohol en el organismo
y como reacciona en el metabolismo, te escribo las reacciones de descomposición
del alcohol etílico dentro de nuestro cuerpo, por oxidación
del Etanol tenemos:
Alcohol Etilico + Dioxigeno...........Acetaldehido...+ Agua
CH3-CH2-OH + 1/2 O2 -----------------> CH3-CH=O + H2O
Es decir, que lo primero que produce nuestro cuerpo es
ACETALDEHIDO, la oxidación del etanol en el metabolismo del cuerpo humano se
considera como principal factor para la aparición de la resaca tras la ingesta
de bebidas alcohólicas, también produce varios efectos al cuerpo que hace que
el cuerpo intente eliminarlo del cuerpo, mediante la piel, mediante el aliento,
y la parte que procesa el hígado, la trata de eliminar lo más pronto posible,
transformándolo en grasa en la parte abdominal del cuerpo, la cual provoca lo
que se conoce como "barriga de cervecero".
La segunda Reacción, es la descomposicion del acetaldehido a acido acetico
Acetaldehido + Oxígeno...................Acido Acetico +
Agua
CH3-CH=O + O2 -----------------------> CH3-OH.C=O + H2O
BALANCEADA
2 CH3-CH=O + 2 O2 -----------> 2 CH3-OH.C=O + O2
Este es el que provoca dolor de garganta, vómito, diarrea,
dolor abdominal, sensación de quemazón en el tracto digestivo, etc
4. La Tercera y ultima REACCION es la Descomposicion del
ACIDO ACETICO EN CO2 Y H20
Acido Acetico + Oxígeno..............Dióxido de carbono +
Agua
CH3-OH.C=O + 2 O2 ---------------------> 2 CO2 + 2H2O
BALANCEADA
CH3-OH.C=O + 2 O2 ---------------------> 2 CO2 + 2H2O
NOMENCLATURA DE ALCOHOLES - REGLAS IUPAC
Regla 1. Se elige como cadena principal la de mayor longitud
que contenga el grupo -OH.
Regla 2. Se numera la cadena principal para que el grupo -OH
tome el localizador más bajo. El grupo hidroxilo tiene preferencia sobre
cadenas carbonadas, halógenos, dobles y triples enlaces.
Regla 3. El nombre del alcohol se construye cambiando la
terminación -o del alcano con igual número de carbonos por -ol
Regla 4. Cuando en la molécula hay grupos grupos funcionales
de mayor prioridad, el alcohol pasa a serun mero sustituyente y se llama
hidroxi-. Son prioritarios frente a los alcoholes: ácidos carboxílicos,
anhídridos, ésteres, haluros de alcanoilo, amidas, nitrilos, aldehídos y
cetonas.
Regla 5. El grupo -OH es prioritario frente a los alquenos y
alquinos. La numeración otorga el localizador más bajo al -OH y el nombre de la
molécula termina en -ol.

El grupo funcional característico de los aldehídos es el grupo carbonilo. Para los aldehídos el carbono carbonilo siempre es un carbono terminal y se encuentra enlazado a un hidrógeno.
Aldehído significa " alcohol deshidrogenado". Estos compuestos se pueden considerar como producto de la oxidación parcial de alcoholes primarios .
Los aldehídos se forman cuando en el grupo funcional de los alcoholes primarios (-CH2-OH), se eliminan dos átomos de hidrógeno. Aldehido: CH3-CH=O
La fórmula general condensada para un aldehido se abrevia como R – CHO y la de una
Para nombrar los aldehidos, la “o” final del nombre del alcano respectivo se sustituye por el sufijo “al”. Para los miembros inferiores de la familia predomina el empleo de los nombres comunes como por ejemplo: Metanal o formaldehido, HCHO; etanal o acetaldehido, CH3 – CHO; propanal o propionaldehido, CH3 – CH2 – CHO; butanal o butiraldehido, CH3 – CH2 – CH2 – CHO; ventanal o valeraldehido, CH3 – CH2 – CH2 – CH2 - CHO y benzaldehido, C6H5 - CHO
PROPIEDADES FÍSICAS DE ALDEHIDOS
Casi todos los aldehídos son líquidos. Los miembros inferiores son de olor agradable, muchos otros se emplean en la fabricación de perfumes y sabores artificiales. El formaldehído y el acetaldehído son infinitamente solubles en agua, los homólogos superiores no son hidrosolubles. Los aldehídos son menos densos que el agua e incoloros.
PROPIEDADES QUÍMICAS DE LOS ALDEHIDOS
Las reacciones químicas de los aldehídos son función del grupo carbonilo. Por su mayor electronegatividad, el oxígeno atrae el par electrónico mas hacia él alejándolo del carbono. En consecuencia, la distribución electrónica del enlace no resulta simétrica; el oxígeno es ligeramente negativo y el carbono ligeramente positivo. El grupo carbonilo puede representarse como dos formas resonantes, una neutra y otra con doble carga
Al examinar los productos que se forman cuando los reactivos se adicionan al doble enlace carbono – oxígeno, el fragmento positivo del reactivo siempre se adiciona al oxígeno y el fragmento negativo se une al carbono
CETONAS
El grupo carbonilo en los aldehídos está unido a un átomo de hidrógeno y a un radical alquilo
En el caso de las cetonas este grupo carbonilo se une a dos radicales alquilo.
Las cetonas son compuestos que resultan de la oxidación moderada de alcoholes secundarios ( CH - OH) pierde dos átomos de hidrógeno.
Propiedades Físicas
Los compuestos carbonílicos presentan puntos de ebullición más bajos que los alcoholes de su mismo peso molecular. No hay grandes diferencias entre los puntos de ebullición de aldehídos y cetonas de igual peso molecular. Los compuestos carbonílicos de cadena corta son solubles en agua y a medida que aumenta la longitud de la cadena disminuye la solubilidad.
Propiedades Químicas
Las cetonas se comportan como ácidos debido a la presencia del grupo carbonilo, esto hace que presenten reacciones típicas de adición nucleofílica.
Reacciones de adición nucleofílica: Estas reacciones se producen frente al (reactivo de Grignard), para dar origen a un oxihaluro de alquil-magnesio que al ser tratado con agua da origen a un alcohol. El metanol forma alcoholes primarios y los demás aldehídos forman alcoholes secundarios.
NOMECLATURA DE ALDEHÍDOS Y CETONAS- REGLAS IUPAC
Regla 1. Los aldehídos se nombran reemplazando la
terminación -ano del alcano correspondiente por -al. No es necesario
especificar la posición del grupo aldehído, puesto que ocupa el extremo de la
cadena (localizador 1).
Cuando la cadena contiene dos funciones aldehído se emplea
el sufijo -dial.
Regla 2. El grupo -CHO se denomina -carbaldehído. Este tipo
de nomenclatura es muy útil cuando el grupo aldehído va unido a un ciclo. La
numeración del ciclo se realiza dando localizador 1 al carbono del ciclo que
contiene el grupo aldehído.
Regla 3. Cuando en la molécula existe un grupo prioritario
al aldehído, este pasa a ser un sustituyente que se nombra como oxo- o formil-.
Tanto -carbaldehído como formil- son nomenclaturas que
incluyen el carbono del grupo carbonilo. -carbaldehído se emplea cuando el
aldehído es grupo funcional, mientras que formil- se usa cuando actúa de
sustituyente.
Regla 4. Algunos nombres comunes de aldehídos aceptados por
la IUPAC son:
Regla 5. Las cetonas se nombran sustituyendo la terminación
-ano del alcano con igual longitud de cadena por -ona. Se toma como cadena
principal la de mayor longitud que contiene el grupo carbonilo y se numera para
que éste tome el localizador más bajo.
Regla 6. Existe un segundo tipo de nomenclatura para las
cetonas, que consiste en nombrar las cadenas como sustituyentes, ordenándolas
alfabéticamente y terminando el nombre con la palabra cetona.
Regla 7. Cuando la cetona no es el grupo funcional de la
molécula pasa a llamarse oxo-.
ÉTERES
Los éteres son compuestos que se consideran el producto de
la deshidratación de dos moléculas de alcohol, o bien como derivado del agua al
ser sustituido los hidrógenos por dos radicales alquilo. La fórmula general de
los éteres es:
R - O - R
Los éteres puede presentar radicales iguales ( R-O-R )
los cuales son llamados éteres simples y si presenta radicales diferentes ( R-O-R' )
son llamados éteres mixtos.
NOMENCLATURA DE ÉTERES
De acuerdo con la IUPAC para nombrar a los éteres,
consideraremos que un hidrógeno del hidrocarburo es sustituido por un radical R-O- al
que llamaremos alcoxi, siendo relacionado como grupo alcoxi el radical más
sencillo. Algunos ejemplos de radicales alcoxi son:
CH3-O-
Metoxi
CH3-CH2 -O -
Etoxi
CH3-CH2-CH2-O-
Propoxi
CH3-CH2-CH2-CH2-O-
Butoxi
Se debe contar primero la cadena continua más larga de
átomos de carbono. El grupo más pequeño se nombra como grupo alcoxi,
Anteponiendo el número o números que sostienen al radical alcoxi. (Si presenta
otros radicales o insaturaciones se seguirán prioridades)
Se debe contar primero la cadena continua más larga de
átomos de carbono. El grupo más pequeño se nombra como grupo alcoxi,
Anteponiendo el número o números que sostienen al radical alcoxi. (Si presenta
otros radicales o insaturaciones se seguirán prioridades)
CH3-O-CH2-CH3
Metoxietano
CH3-O-CH2-CH2-CH3 Metoxipropano
CH3-O-CH2-CH2-CH2-CH3 Metoxibutano
CH3-CH2-O-CH2-CH3 Etoxietano
CH3-CH2-O-CH2-CH2-CH3 Etoxipropano
CH3-CH2-O-CH2-CH2-CH2-CH3 Etoxibutano
Existe otra forma de nombrar a los éteres y es por nombre
común. Se escribe primero la palabra éter seguida de los radicales alquílicos
con terminación ico. Cuando los grupos son idénticos, se puede usar el prefijo
di, aunque es opcional. Si los radicales son diferentes se nombran por orden
alfabético.
CH3-O-CH3 éter
dimetílico ó eter metílico
CH3- CH2- O- CH2-CH3
éter dietílico ó eter etílico
CH3- O-CH2-CH3
éter metil etílico
CH3-O-CH2- CH2-CH3
éter metil propílico
OBTENCIONES
Se pueden obtener éteres por deshidratación de alcoholes
calentándolos con ácidos sulfúrico a 140º (como catalizador).
cat. a 140º
2 CH3 -CH2 -OH
------------------> CH3 -CH2 -O -CH2 -CH3 +
H2O
Se puede preparar éteres tanto simples como mixtos haciendo
reaccionar un alcoholato de sodio con yoduro de alquilo (método de williamson)
CH3 -CH2 -ONa
+ CH3 -I ------> CH3-O-CH2 -CH3 +
NaI
Etóxido de sodio + yoduro de metilo---> metoxietano +
yoduro de sodio
PROPIEDADES FÍSICAS
En general son líquidos, su puntos de ebullición es mas bajo
que el alcohol correspondiente. Son incoloros, más ligeros que el agua y de
olor agradable. Sus densidades están comprendidas entre 0.71 y 0.97 g/ml. Son
poco solubles en agua y excelentes disolventes, pero los más sencillos son muy
volátiles e inflamables.
PROPIEDADES QUÍMICAS
Los éteres reaccionan con ácido yodhídrico con incremento de
temperatura obteniendo un derivado halogenado y alcohol. Si se varia la
temperatura e incrementa la cantidad de ácido los resultados cambian. En
el caso de un éter asimétrico, el radical más ligero es el que halógena
primeramente.
CH3-O-CH3 +
HI --------> CH3-I + CH3-OH
CH3-O-CH3 +
2 HI --------> 2 CH3-I + H2O
CH3-CH2-CH2-O-CH3+
HI -----> CH3-CH2-CH2-OH + CH3-I
ACIDOS CARBOXILICOS
Los ácidos carboxílicos (ácidos orgánicos)son compuestos que
contienen en su molécula el grupo funcional llamado carboxilo (-CO.OH). En una
misma molécula pueden haber dos o más grupos caboxilos, siendo éstos los ácidos
dicarboxílicos. También pueden haber en una misma molécula, además del grupo
carboxilo, otros grupos funcionales, como OH, NH2, etc., y entonces
se denominan ácidos de Función mixta.
Los ácidos monobásicos (monocarboxílicos) reciben el nombre
de ácidos grasos. Este nombre se debe a que algunos de los miembros superiores
de la serie, en particular los ácidos palmítico y esteárico, se encuentran en
las grasas naturales.
Los ácidos orgánicos pueden ser representados de la
siguiente manera:
R - CO.OH
NOMENCLATURA:
Para nombrar estos compuestos se puede hacer de varias
maneras.
1.- Según la IUPAC, el nombre de los ácidos carboxílicos se
hace derivar del hidrocarburo correspondiente con terminación "oico",
considerando el carbono 1 al carbono del grupo funcional.
H - CO.OH ácido
metanoico
CH3 - CO.OH
ácido etanoico
CH3 - CH2 - CO.OH
ácido propanoico
CH3 - CH2 - CH2 -CO.OH
ácido butanoico
CH3 - CH2- CH2- CH2-CO.OH
ácido pentanoico
CH3 -
CH2 - CH2- CH2- CH2-CO.OH
ácido hexanoico
CH3 -
CH2- CH2- CH2- CH2- CH2-CO.OH
ácido heptanoico
CH3 -
CH2- CH2- CH2- CH2- CH2-
CH2-CO.OH ácido octanoico
CH3 -
CH2 - CH2- CH2- CH2- CH2-
CH2- CH2-CO.OH ácido
nonanoico
CH3 -
CH2 - CH2 - CH2- CH2- CH2-
CH2- CH2- CH2-CO.OH
ácido decanoico
Si la molécula contiene más de dos grupos carboxílicos, se
antepone a la terminación "oico", el prefijo di, tri, etc.
HO.OC - CH2- CO.OH
ácido propanodioico
2.- Otra nomenclatura, es la que usa la terminación
"carboxílico", pero la numeración de la cadena base es diferente. Se
considera el carbono 1 al que está unido al grupo funcional.
3.- Otra manera de nombrarlos es el nombre común,
relacionada a las raíces griegas o latinas del nombre con la fuente de
aturaleza donde han sido aislados.
EJEMPLO:
H - COOH Ácido Fórmico
CH3 - COOH
Ácido Acético
CH3 - CH2 -COOH
Ácido Propiónico
CH3 - (CH2) 2 -COOH
Ácido Butírico
CH3 - (CH2) 3 -COOH
Ácido Valeriánico
CH3 - (CH2)4 -COOH
Ácido Caproico
CH3 - (CH2)5 -COOH
Ácido Enantico
CH3 - (CH2)6 -COOH
Ácido Caprílico
CH3 - (CH2)7 -COOH
Ácido Pelargónico
CH3 - (CH2)8 -COOH
Ácido Cáprico
Mís ejemplos de nomenclatura común. Observa cuantos átomos
de carbono posee cada molícula.
CH3 - (CH2)10 -COOH
Ácido láurico
CH3 - (CH2)12 -COOH
Ácido miristico
CH3 - (CH2)14 -COOH
Ácido palmítico
CH3 - (CH2)15 -COOH
Ácido margánico
CH3 - (CH2)16 -COOH
Ácido esteárico
Algunos ejemplos de ácidos dicarboxilicos son:
HO.OC - CO.OH Ácido
oxálico
HO.OC - CH2 - CO.OH
Ácido malónico
HO.OC - ( CH2 )2 - CO.OH
Ácido succínico
HO.OC - ( CH2 )3 - CO.OH
Ácido glutámico
El ácido fórmico recibió su nombre trivial porque se obtuvo
de la hormiga roja (del latín formica = hormiga). El ácido acético (del latin,
aceticum) porque proviene su nombre del vinagre que lo contiene en un 5%. El
ácido propiónico (del griego; protos, primero; pion, grasa) y se obtiene de
leche, mantequilla y queso. El ácido butírico (del latin: butyrum) se encuentra
en la mantequilla, sudor y manteca rancia al que comunica su olor desagradable.
El ácido Valeriánico (de latín valere) se encuentra en la raíz de valeriano. El
ácido caproico ( del latín: caper = cabra) se encuentra en las secciones
cutáneas de la cabra. El ácido cítrico el cual le da el sabor agrio y picante a
muchos frutos ( 7% en el jugo de limón). El ácido tartárico y sus sales se
encuentran en las uvas y la salsa tártara.
OBTENCIÓN DE ACIDOS CARBOXÍLICOS
Se sabe que los ácidos carboxílicos son compuestos que se
forman al oxidar un aldehído. Esto ocurre por que el hidrógeno del grupo
funcional aldehído (-CHO) se sustituye por el grupo hidroxilo (-OH).
Para obtener el ácido carboxílico se oxida moderadamente un
alcohol primario (en presencia de un catalizador como KMnO4 )
el cual producirá su respectivo aldehído y a su vez al seguir oxidando
producirá el respectivo ácido carboxílico.
Hidrólisis
de ésteres.
CH3 -
COO - CH2 - CH3 + H2O -------> CH3 -
COOH + CH3- CH2-OH
Etanoato de etilo (éster) + agua ------> Ácido etanoico +
Etanol
PROPIEDADES FÍSICAS DE LOS ACIDOS CARBOXÍLICOS.
Los tres primeros términos de la serie de ácidos grasos son
líquidos incoloros de olor picante y desagradable.
Presentan puntos de ebullición altos y se elevan conforme
aumenta el número de átomos de carbono.
Los tres primeros son insolubles en agua y esta solubilidad
disminuye, conforme aumenta él número de átomos de carbono. A partir del ácido
octanoico son insolubles en agua.
Son líquidos hasta el ácido decanoico.
PROPIEDADES QUIMICAS DE LOS ACIDOS CARBOXÍLICOS
Los ácidos carboxílicos son ácidos débiles que al reaccionar
con los alcoholes formando ésteres.
CH3 -
COOH + CH3 - CH2 - OH --> CH3 -
COO - CH2 - CH3 + H2O
Los jabones son sales alcalinas de ácidos grasos que se
obtienen por saponificación, en cuya reacción se efectúa en caliente, con una
grasa (ácido carboxílico) y un álcali; sosa cáustica para los jabones duros ó
potasa cáustica para los jabones blandos.
ÉSTERES
Los ésteres son compuestos que provienen de los ácidos
carboxílicos al reaccionar con alcohol. Presentan un grupo funcional parecido
al de los ácidos pero el átomo de hidrógeno es sustituido por un radical
alquilo. Su grupo funcional es: -CO O-
Su fórmula es:
R-CO.O -R
NOMENCLATURA
Para nombrar a los ésteres se sustituye la terminación
"oico" del ácido del que provienen por 'ato' y al final se indica el
nombre del radical alquilo.
Ejemplos:

CH3 - CO.O - CH2 - CH3 Etanoato
de etilo
CH3 -
CO.O - CH2- CH2- CH2 - CH3
Etanoato de butilo
CH3 -CO.O - CH2- CH2-
CH2-CH2 - CH3
Etanoato de pentilo
H - CO.O - CH3
Metanoato de Metilo
H - CO.O - CH2- CH3
Metanoato de Etilo
H - CO.O - CH2- CH2 - CH3
Metanoato de propilo
H - CO.O - CH2- CH2- CH2 -
CH3 Metanoato de butilo
H - CO.O - CH2- CH2- CH2-
CH2 - CH3
Metanoato de pentilo
A continuación se presentaran algunos ejemplos, tomando en
cuenta todas las recomendaciones de los temas anteriores.
OBTENCIÓN DE ÉSTERES
Se puede obtener un éster a partir de la reacción de un
ácido carboxilico con alcohol en presencia de un catalizador (ácido sulfúrico)
CH3 -
COOH + CH3 - OH ------>
CH3- CO.O - CH3 + H2O
Ácido etanoico +
metanol ------> Etanoato de metilo + agua
PROPIEDADES FÍSICAS DE LOS ÉSTERES
Son líquidos, excepto los que presentan muchos carbones.
Los primeros ésteres presentan olores a frutas.
Los ésteres con pocos carbones presentan punto de ebullición
inferior a los del alcohol y el ácido que proviene.
Los primeros terminos son pocos solubles en agua.
Son buenos disolventes de sustancias orgánicas.
PROPIEDADES QUÍMICAS DE LOS ÉSTERES
En la hidrólisis, un éster reacciona con agua en presencia
de un ácido fuerte como catalizador. El éster se divide produciendo un ácido
carboxílico y un alcohol.
CH3 -
CO.O - CH3 + H20 -----> CH3 -
CO.OH + CH3 -OH
Etatonoato de metilo +
agua -----> ácido etanóico + metanol
La saponificación es una reacción que se produce al calentar
un éster con una base fuerte ( NaOH ó KOH), produciendo sal del ácido y el
alcohol.
CH3-CH2 -CO.O-
CH3 + NaOH -----> CH3 - CH2-COO-Na
+ CH3 -OH
Propionato de metilo +
hidroxido de sodio -----> Propionato de sodio +
metanol
El proceso de saponificación se usa en la fabricación de
jabones. Desde la antigüedad, se han preparado los jabones a partir de aceites
vegetales y animales o de grasas con hidróxido de sodio o de hidróxido de
potasio. El aceite y las grasas naturales son ésteres. Un jabón es una sal
metálica de un ácido graso.
REFERENCIA:






.jpg)

.jpg)


.jpg)